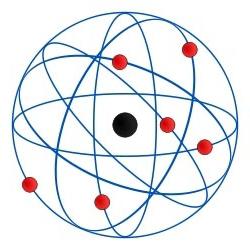
전자 상태의 주된 지표로서의 주요 양자 수
과학적 인식에서 가장 중요한 장소 중 하나현대 세계는 소위 양자 이론에 의해 점령됩니다. 이것은 전자에서 숨겨진 에너지가 계산 될 수 있다는 명제에 기반합니다. 그 크기는 특정 값만 취할 수 있기 때문입니다. 이 상태의 가장 중요한 결과는 한 번에 또 다른 전자의 상태가 양의 지표 인 양자 수 (quantum numbers)로 설명 될 수 있다는 결론입니다.

이 이론에서 가장 중요한 것은양자 수. 현대 물리학에서이 용어는 일반적으로 전자의 주어진 상태가 일정한 에너지 준위를 지칭하는 양적 지표라고 불린다. 에너지 레벨은 차례로 궤도 집합이며, 에너지 값의 차이는 극히 중요하지 않습니다.
이 조항에서 볼 수 있듯이, 중요한 것은양자 수는 양의 자연수 중 하나와 같을 수 있습니다. 이 경우 다른 사실이 근본적으로 중요합니다. 결국, 전자가 다른 에너지 준위로 전이되는 경우 주 양자 수는 반드시 그 값을 바꿀 것입니다. 소립자가 하나의 궤도에서 다른 궤도로 넘어가는 일정한 양의 에너지가 방출되거나 흡수되는 닐스 보어 (Niels Bohr)의 모델과 평행을 이루는 것이 적절합니다.

주요 양자 수는 가장 직접적인 것입니다.궤도 양자 수와 관련있다. 것은 모든 에너지 레벨이 본질적으로 이기종이며 몇 개의 궤도를 포함한다는 것입니다. 같은 에너지 값을 가진 사람들은 별도의 하위 레벨을 형성합니다. 하나 또는 다른 궤도가 어느 하위 레벨에 속하는지를 알아 내고 "궤도 양자 수 (orbital quantum number)"개념을 사용하십시오. 그것을 계산하려면, 기본 양자 수에서 단위를 취할 필요가 있습니다. 그러면 0부터이 지수 u까지의 모든 자연수가 궤도 양자 수입니다.
이 정량의 가장 중요한 기능특성은 그것의 도움으로 전자가 특정 하위 레벨과 상관 될뿐만 아니라 주어진 기본 입자의 운동의 궤도가 특징 지워지는 것입니다. 그러므로, 화학의 교과 과정에서조차도 알려져있는 궤도의 편지 지정과 방법에 의해 : s, d, p, g, f.
위치의 또 다른 중요한 특성전자는 자기 양자 수입니다. 그것의 주요 물리적 의미는 자기장 방향과 일치하는 각운동량의 투영을 특성화하는 것입니다. 즉, 궤도 함수가 차지하는 전자를 구별하기 위해서는 양자 수가 같은 전자기를 구별 할 필요가있다.
자성 양자 수는 다양 할 수있다.제한은 2l + 1이다. 여기서 l은 궤도 양자 수의 정량적 인 특성이다. 또한, 그들은 순수한 형태의 기본 입자의 양자 성질을 특성화하기 위해 필요한 자기 스핀 수 (magnetic spin number)를 방출합니다. 스핀은 운동량의 순간 일 뿐이며, 이는 가상의 축을 중심으로 한 전자의 회전과 비교할 수 있습니다.