원자 구조에 대한 기본 정보 : 특성, 특징 및 공식
Atom은 화학 물질의 가장 작은 입자입니다.그것의 성질을 보존 할 수있는 물질. "원자"라는 단어는 고대 그리스의 "원자 (atomos)"에서 나옵니다. 원자에 얼마나 많은 입자가 있는지에 따라 화학 원소를 결정할 수 있습니다.

원자의 구조에 대해 간략히
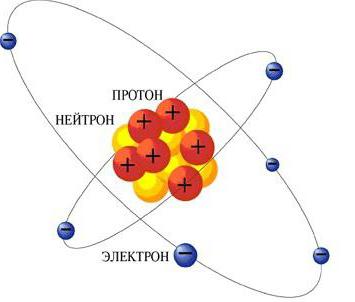
주요 정보를 간단하게 나열하려면 어떻게해야합니까?원자의 구조? 원자는 하나의 핵을 가진 입자이며, 양전하를 띤다. 이 핵 주위에는 음전하를 띤 전자 구름이있다. 정상 상태의 각 원자는 중립입니다. 이 입자의 크기는 핵을 둘러싸는 전자 구름의 크기에 의해 완전히 결정될 수 있습니다.
또한 핵심 자체는작은 입자 - 양성자와 중성자. 양성자는 양전하를 띤다. 중성자는 어떤 책임도지지 않습니다. 그러나 양성자는 중성자와 함께 하나의 범주로 합쳐져 핵자 (nucleons)라고 불린다. 원자 구조에 대한 기본 정보가 간략히 필요한 경우이 정보는 나열된 데이터로 제한 될 수 있습니다.

원자에 관한 첫 번째 정보
같은 것에 관해서는 문제가 작은 것으로 구성 될 수 있습니다.입자, 고대 그리스도 의심. 그들은 존재하는 모든 것이 원자들로 구성되어 있다고 믿었습니다. 그러나 그러한 견해는 순전히 철학적이며 과학적으로 해석 될 수는 없습니다.
원자 구조에 대한 기본 정보가 얻어졌다.영어 과학자 존 달튼. 두 개의 화학 원소가 서로 다른 비율로 들어갈 수 있다는 것을 발견 할 수 있었던 것은이 연구원이었습니다. 그리고 그러한 조합은 새로운 물질이 될 것입니다. 예를 들어, 8 개의 산소 원소가 이산화탄소를 생성합니다. 산소 4 부분은 일산화탄소입니다.
1803 년 달튼은 소위 법칙을 발견했습니다.화학에서 다중 관계. 간접 측정의 도움으로 (이후 현미경 하에서 원자가 고려 될 수 없기 때문에), Dalton은 원자의 상대적 무게에 대해 결론을 내렸다..

Rutherford의 연구
거의 1 세기 후, 원자 구조에 관한 기본 정보가 다른 영어 화학자 인 Ernest Rutherford에 의해 확인되었습니다. 과학자는 가장 작은 입자의 전자 껍질 모델을 제안했습니다.
그 당시 러더퍼드에 의해 "Planetary원자의 모델 "은 화학이 할 수있는 가장 중요한 단계 중 하나였습니다. 원자의 구조에 관한 기본 정보는 태양계와 유사하다는 것을 보여 주었다. 행성처럼 정확하게 정의 된 궤도에서 입자 전자가 핵 주위를 돌고있다.
원자의 전자 껍질과 화학 원소의 원자의 공식
각 원자의 전자 껍질은양성자 중심핵에있는만큼 많은 전자가 있습니다. 그것이 원자가 중성 인 이유입니다. 1913 년에 다른 과학자는 원자 구조에 대한 기본 정보를 받았다. Niels Bohr의 공식은 Rutherford를받은 것과 비슷합니다. 그의 개념에 따르면, 전자는 중심에 위치한 핵 주위를 회전한다. Bor은 Rutherford의 이론을 세련하고 그 사실에 조화를 도입했습니다.
이미 몇 가지 화학 물질의 공식이 만들어졌습니다. 예를 들어, 질소 원자의 구조를 개략적으로 1s22 초22p3, 나트륨 원자의 구조는 화학식 1s22 초22p63 대1. 이 공식을 통해 얼마나 많은 전자가 화학 물질의 각 궤도를 따라 이동하는지 확인할 수 있습니다.

슈뢰딩거 모델
그러나이 원자 모델은 또한 쓸모가 없습니다. 오늘날 과학에 알려진 원자 구조에 대한 기본 정보는 오스트리아의 물리학자인 슈뢰딩거 (E. Schrödinger)의 연구로 인해 크게 유용하게되었다.
그는 그 구조의 새로운 모델 - 물결을 제안했습니다. 이 시간까지 과학자들은 이미 전자가 입자의 성질뿐 아니라 파동의 특성을 가지고 있음을 증명했다.
그러나 Schrödinger와 Rutherford 모델에는 일반적인 조항이 있습니다. 그들의 이론은 전자가 일정 수준에서 존재한다는 점에서 유사하다.
이러한 레벨을 전자 층이라고도합니다. 레벨 번호를 사용하여 전자 에너지를 특성화 할 수 있습니다. 레이어가 높을수록 더 많은 에너지를 갖습니다. 모든 레벨은 상향식으로 계산되므로 레벨 수는 에너지에 해당합니다. 원자의 전자 껍질에있는 각 층에는 하위 수준이 있습니다. 두 제 - - 따라서 제 1 레벨 일 개 계층, 제 일 수있다. (화학식 전자 질소 나트륨 위 참조) 세 등.

심지어 더 작은 입자들
지금은 물론 더 많은전자, 양성자 및 중성자 라기보다는 작은 입자. 양성자는 쿼크들로 구성되어있는 것으로 알려져있다. 우주의 더 작은 입자들도 있습니다. 예를 들면, 크기가 쿼크보다 백배 작고 양성자보다 10 억 배 작은 중성미자.
중성미자는 입자가 너무 작아서 예를 들어 티라노사우루스보다 10 배나 작습니다. 티라노사우르 자체는 관측 가능한 전체 우주보다 훨씬 작습니다.
원자 구조에 관한 기본 정보 : 방사능
어떤 화학 반응도 한 원소를 다른 것으로 변환시킬 수 없다는 것이 항상 알려져 있습니다. 그러나 방사선 방사 과정에서 이것은 자발적으로 발생합니다.
방사능은 원자핵의 능력이다.다른 핵으로 - 더 안정. 사람들이 원자 구조에 관한 기본적인 정보를 얻었을 때, 동위 원소는 중세의 연금술사들의 꿈의 구체화로 작용할 수 있습니다.
동위 원소 방출의 붕괴 동안방사성 방사선. 처음으로 이러한 현상은 Becquerel에 의해 발견되었습니다. 방사능 방사선의 주요 형태는 알파 붕괴이다. 그것으로 알파 입자가 방출됩니다. 또한 베타 붕괴 (beta decay)가 있는데, 베타 입자가 원자핵에서 각각 방출됩니다.
자연 및 인공 동위 원소
현재 약 40 여종동위 원소. 대부분은 우라늄 - 라듐, 토륨 및 악티늄의 3 가지 카테고리에 있습니다. 이 모든 동위 원소는 암석, 토양, 대기에서 자연에서 발견 될 수 있습니다. 그러나 그들과 별개로, 원자로에서 얻어지는 인위적으로 약 천개의 인위적인 인공위성이있다. 많은 동위 원소가 의학, 특히 진단에 사용됩니다..

원자 내부의 비율
우리가 상상할 수있는 원자의 크기국제 스포츠 경기장의 크기와 비교 될 것입니다. 그러면 시각적으로 다음 비율을 얻을 수 있습니다. 그러한 "경기장"에있는 원자의 전자는 스탠드의 맨 위에 위치 할 것입니다. 각각은 핀 머리보다 작을 것입니다. 그러면 핵심은이 필드의 중심에 위치 할 것이고 그 크기는 완두콩의 크기보다 크지 않을 것입니다.
때로는 사람들이 질문을합니다. 현실에서원자처럼 보입니다. 실제로, 그것은 말 그대로 어떤 방식으로도 보이지 않습니다 - 과학에서 불충분하게 좋은 현미경이 사용되는 이유가 아닙니다. 원자의 크기는 "가시성"이라는 개념이 단순히 존재하지 않는 영역에있다.
원자의 크기는 매우 작습니다. 그러나 이러한 치수는 실제로 얼마나 작습니까? 사실 인간 눈의 가장 작고 거의 식별 할 수없는 입자는 약 1 백만 개의 원자를 포함합니다.
우리가이 크기의 원자를 상상한다면,인간의 손에 꼭 들어 맞을 수 있고 그 옆에 300 미터 길이의 바이러스가있을 것입니다. 박테리아는 3km의 길이를 가지며 인간의 머리카락 두께는 150km와 같습니다. 거짓말 쟁이로 그는 지구의 대기권 경계를 넘어 설 수 있습니다. 그리고 그러한 비율이 진짜라면, 인간의 머리카락이 달에 달할 수 있습니다. 이것은 매우 불안하고 흥미로운 원자로, 오늘날 과학자들이 계속 연구하고 있습니다.</ span </ p>